Derajat ionisasi adalah perbandingan antara jumlah zat yang mengion dengan jumlah zat mula mula, dan disimbolkan dengan 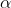 .
.
Derajat ionisasi dapat dinyatakan dengan 2 kondisi yaitu dengan skala 0 - 1 dan dengan persen. Secara matematika dapat ditulikan sebagai berikut :

dengan menggunakan rumus diatas maka kita akan dapatkan hasil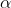 nya dalam skala 0 - 1. Untuk mengubanhnya kedalam persen kalian tinggal kali saja dengan 100. Cukup mudah tentunya.
nya dalam skala 0 - 1. Untuk mengubanhnya kedalam persen kalian tinggal kali saja dengan 100. Cukup mudah tentunya.
Jika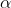 yang kita dapatkan :
yang kita dapatkan :


Jumlah zat yang mengion menjadi = x .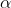
Kemudian kita akan membuat stoikiometri reaksi kesetimbangan ionisasi baik asam maupun basa. Yang akan saya contohkan disini adalah asam lemah dimana jumlah zat mula mula adalah x dan jumlah zat mengion adalah x.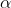
HA(aq) <==> H+(aq) + A-(aq)
Mula mula x - -
Reaksi x.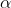 x.
x.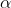 x.
x.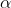
Setimbang x(1 -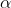 ) x.
) x.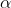 x.
x.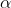
Berdasarkan stoikiometri diatas, maka kita dapat menulis konstanta kesetimbangan asam lemah sebagai berikut :
(x\alpha)}{x(1-\alpha&space;)})
Bisanya untuk asam dan basa lemah, nilai derajat ionisasinya sangat kecil sehingga harga 1 -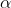 dapat kita anggap hasilnya 1.Maka rumus diatas akan menjadi :
dapat kita anggap hasilnya 1.Maka rumus diatas akan menjadi :
(x\alpha)}{x})
 ( inilah hubungan Ka terhadap derajat ionisasi asam)
( inilah hubungan Ka terhadap derajat ionisasi asam)
Jika ingin mencari harga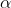 maka rumusnya menjadi :
maka rumusnya menjadi :
![\alpha = \sqrt[2]{\frac{Ka}{x}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\alpha&space;=&space;\sqrt[2]{\frac{Ka}{x}})
Dimana x adalah konsentrasi dari asam lemah.
Dengan cara yang sama juga akan kita dapatkan rumus hubungan derajat ionisasi (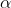 ) dengan konstanta kesetimbangan basa lemah (Kb) sebagai berikut.
) dengan konstanta kesetimbangan basa lemah (Kb) sebagai berikut.

![\alpha = \sqrt[2]{\frac{Kb}{x}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\alpha&space;=&space;\sqrt[2]{\frac{Kb}{x}})
Agar lebih paham maka perhatikanlah contoh soal dibawah ini
Soal 1
Tetapan ionisasi suatu asam adalah . Berapa persenkah asam itu mengion dalam larutan dengan konsentrasi :
. Berapa persenkah asam itu mengion dalam larutan dengan konsentrasi :
a. 0,1 M
b. 0,01 M
Pembahasan:
a.Dalam larutan asam dengan konsentrasi 0,1 M
![\alpha = \sqrt[2]{\frac{Ka}{x}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\alpha&space;=&space;\sqrt[2]{\frac{Ka}{x}})
![\alpha = \sqrt[2]{\frac{1 x 10^{-5}}{0,1}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\alpha&space;=&space;\sqrt[2]{\frac{1&space;x&space;10^{-5}}{0,1}})

 x 100% = 1 %
x 100% = 1 %
b. Dalam larutan asam dengan konsentrasi 0,001 M
![\alpha = \sqrt[2]{\frac{Ka}{x}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\alpha&space;=&space;\sqrt[2]{\frac{Ka}{x}})
![\alpha = \sqrt[2]{\frac{1 x 10^{-5}}{0,01}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\alpha&space;=&space;\sqrt[2]{\frac{1&space;x&space;10^{-5}}{0,01}})

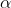 = 0,1 x 100 % = 10 %
= 0,1 x 100 % = 10 %
Dari contoh soal ini dapat kalian ambil kesimpulan bahwa semakin besar konsentrasi asam atau basa maka jumlah molekul yang dapat larut akan semakin sedikit. Dengan konsentrasi 0,1 M yang lebih besar dibandingkan 0,001 M, jumlah zat yang dapat mengion hanya 1 % lebih kecil dibandingkan dengan konsentrasi 0,001 M yaitu 10%.
Kesimpulan:
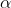 berbanding terbalik dengan konsentrasi asam atau basa lemah.
berbanding terbalik dengan konsentrasi asam atau basa lemah.
Soal 2
Larutan basa LOH 0,1 M mengion sebanyak 2%.Berapa nilai tetapan kesetimbangan (Kb) basanya?
Pembahasan :
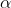 = 2 % = 2/100 = 0,02 =
= 2 % = 2/100 = 0,02 = 

= 0,1 M x ( )^2
)^2
= 0,1 x 4 x 10^-4
=
Nah dari dua contoh yang telah diberikan tentu kalian sudah paham dan bisa menggunakan rumus diatas dalam berbagai soal. Terimakasih telah berkunjung.
dengan menggunakan rumus diatas maka kita akan dapatkan hasil
Jika
= 1, maka zatnya mengion sempurna. Dalam pembahasan bab ini yaitu asam dan basa kuat
= 0, maka zatnya tidak mengion sama sekali
- 1 <
< 0 = maka artinya senyawa hanya mengion sebagian. Dalam pembahasan bab ini adalah asam dan basa lemah
Dalam postingan sebelumnya kita sudah membahas tentang tetapan kesetimbangan asam dan basa lemah atau Ka dan Kb. Ka dan Kb menjadi parameter kekuatan asam atau basa lemah dimana jika Ka dan Kb nya besar, maka kekuatannya juga semakin besar.
Sebagaimana yang disebutkan diatas bahwa rumus 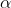 adalah sebagai berikut :
adalah sebagai berikut :
Jika kita misalkan konsentrasi asam atau basa lemah mula mula adalah x M, maka rumusnya akan mejadi.
Jumlah zat yang mengion menjadi = x .
Kemudian kita akan membuat stoikiometri reaksi kesetimbangan ionisasi baik asam maupun basa. Yang akan saya contohkan disini adalah asam lemah dimana jumlah zat mula mula adalah x dan jumlah zat mengion adalah x.
HA(aq) <==> H+(aq) + A-(aq)
Mula mula x - -
Reaksi x.
Setimbang x(1 -
Berdasarkan stoikiometri diatas, maka kita dapat menulis konstanta kesetimbangan asam lemah sebagai berikut :
Bisanya untuk asam dan basa lemah, nilai derajat ionisasinya sangat kecil sehingga harga 1 -
Jika ingin mencari harga
Dimana x adalah konsentrasi dari asam lemah.
Dengan cara yang sama juga akan kita dapatkan rumus hubungan derajat ionisasi (
Agar lebih paham maka perhatikanlah contoh soal dibawah ini
Soal 1
Tetapan ionisasi suatu asam adalah
a. 0,1 M
b. 0,01 M
Pembahasan:
a.Dalam larutan asam dengan konsentrasi 0,1 M
b. Dalam larutan asam dengan konsentrasi 0,001 M
Dari contoh soal ini dapat kalian ambil kesimpulan bahwa semakin besar konsentrasi asam atau basa maka jumlah molekul yang dapat larut akan semakin sedikit. Dengan konsentrasi 0,1 M yang lebih besar dibandingkan 0,001 M, jumlah zat yang dapat mengion hanya 1 % lebih kecil dibandingkan dengan konsentrasi 0,001 M yaitu 10%.
Kesimpulan:
Soal 2
Larutan basa LOH 0,1 M mengion sebanyak 2%.Berapa nilai tetapan kesetimbangan (Kb) basanya?
Pembahasan :
= 0,1 M x (
= 0,1 x 4 x 10^-4
=
Nah dari dua contoh yang telah diberikan tentu kalian sudah paham dan bisa menggunakan rumus diatas dalam berbagai soal. Terimakasih telah berkunjung.
