Perubahan entalpi standar ( ) adalah perubahan entalpi (
) adalah perubahan entalpi ( ) reaksi yang diukur pada kondisi standar, yaitu pada suhu 298 K dan tekanan 1 atm. Satuan
) reaksi yang diukur pada kondisi standar, yaitu pada suhu 298 K dan tekanan 1 atm. Satuan  adalah kJ dan satuan
adalah kJ dan satuan  molar reaksi adalah kJ/mol.
molar reaksi adalah kJ/mol.
Ada beberapa jenis perubahan entalpi standar. Jenis ini didasarkan pada jenis reaksi kimia yang terjadi.
Entalpi pembentukan standar adalah  untuk membentuk 1 mol persenyawaan langsung dari unsur-unsurnya yang diukur pada 298 K dan tekanan 1 atm.
untuk membentuk 1 mol persenyawaan langsung dari unsur-unsurnya yang diukur pada 298 K dan tekanan 1 atm.
Contoh :
Reaksi 1 :
Perhatikan koefisien  pada reaksi yaitu 1 artinya reaksi diatas tergolong reaksi pembentukan standar 1 mol
pada reaksi yaitu 1 artinya reaksi diatas tergolong reaksi pembentukan standar 1 mol  langsung dari unsur unsurnya yaitu hidrogen dan oksigen. Pada pemebntukan 1 mol
langsung dari unsur unsurnya yaitu hidrogen dan oksigen. Pada pemebntukan 1 mol  ini dilepaskan energi sebesar 285,85 kJ (Lihat tanda ?Hf yang bernilai negatif, artinya reaksi diatas tergolong ke dalam reaksi eksoterm dengan pelepasan sejumlah energi kelingkungan)
ini dilepaskan energi sebesar 285,85 kJ (Lihat tanda ?Hf yang bernilai negatif, artinya reaksi diatas tergolong ke dalam reaksi eksoterm dengan pelepasan sejumlah energi kelingkungan)
Reaksi 2:
Koefisien C2H2 pada reaksi diatas, adalah 2 artinya reaksi diatas bukan reaksi pembentukan standar C2H2. Untuk mengubahnya menjadi reaksi pembentukan standar C2H2, maka semua koefisien senyawa pada reaksi dibagi 2 termasuk harga  . Hasilnya adalah :
. Hasilnya adalah :
Artinya, pada pembentukan 1 mol C2H2 dari unsur karbon dan unsur hidrogen dibutuhkan kaor sebesar 227 kJ (tanda  pada reaksi diatas adalag positif sehingga reaksi tergolong ke dalam reaksi endoterm).
pada reaksi diatas adalag positif sehingga reaksi tergolong ke dalam reaksi endoterm).
Catatan :
Ingat:
Massa 1 mol = Mr zat (satuan gram/mol).
Contoh:
Massa 1 mol 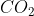 = Mr
= Mr 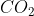 = 44 gram/mol
= 44 gram/mol
Volume 1 mol zat pada keadaan standar (STP) adalah 22,4 liter/mol.
Untuk unsur mempunyai bentuk alotropi, bentuk standar dari unsurnya adalah bentuk yang paling stabil pada keadaan standar (298 K, 1 atm). Contoh, karbon memiliki tiga bentuk alotropi yaitu intan, grafit dan fulleren tetapi bentuk yang paling stabil dari karon adalah grafit, sehingga grafit adalah bentuk standar dari karbon.
Latihan Soal dan Pembahasan
Soal 1
a. 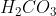 (l) = –125 kJ/mol
(l) = –125 kJ/mol
b. 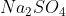 (s) = –334 kJ/mol
(s) = –334 kJ/mol
c. 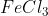 (s) = –214 kJ/mol
(s) = –214 kJ/mol
Tulislah persamaan termokimia reaksi pembentukan zat-zat tersebut!
Pembahasan :
Untuk membuat persamaan termokimia reaksi pemebntukan standar, ingatlah aturan berikut :
- zat yang dibentuk selalu berada di produk (kanan)
- koefisien zat yang dibentuk selalu 1, sehingga untuk menyetarakan ubahlah koefisen yang zat yang berada di sebelah kiri (reaktan). Jangan pernah ubah koefisien zat yang dibentuk selain 1, karena ini adalah reaksi pembentukan standar.
- identifikasilah atom penyusun senyawa tersebut, dan buatlah unsur - unsur pembentuknya sesuai dengan yang ada di alam. Misalnya suatu senyawa tersusun dari atom H dan C berarti unsur unsur pembentukanya adalah gas H2 dan C.
a. Reaksi pembentukan 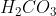 (l)
(l)
Senyawa 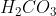 terdiri dari unsur H, C dan O berarti unsur pembentuknya adalah
terdiri dari unsur H, C dan O berarti unsur pembentuknya adalah 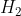 , C dan
, C dan 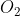 .
.
Persamaan termokimia
Setelah itu tinggal setarakan
b Reaksi Pembentukan 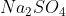
Senyawa 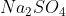 terdiri dari unsur Na, S dan O berarti unsur pembentuknya adalah Na, S dan
terdiri dari unsur Na, S dan O berarti unsur pembentuknya adalah Na, S dan 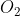
Persamaan termokimia
c. Reaksi pemebntukan 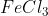
Senyawa 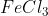 terdiri dari unsur Fe dan Cl berarti unsur pembentuknya adalah Fe dan
terdiri dari unsur Fe dan Cl berarti unsur pembentuknya adalah Fe dan 
Persamaan termokimia
Soal 2
Diketahui persamaan termokimia:
Pembahasan :
Reaksi diatas adalah reaksi pemebntukan 2 mol 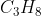 dengan melepaskan kalor sebesar 225 kJ. Untuk membuatnya menjadi reaksi pemebntukan standar, kita harus ubah koefisien
dengan melepaskan kalor sebesar 225 kJ. Untuk membuatnya menjadi reaksi pemebntukan standar, kita harus ubah koefisien 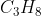 menjadi 1 dengan cara membagi 2 seluruh koefisien reaksi termasuk harga
menjadi 1 dengan cara membagi 2 seluruh koefisien reaksi termasuk harga  nya
nya
Reaksinya menjadi :
Besar entalpi pemebtukan standar 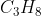 adalah - 112,5 kJ/mol (melepaskan kalor sehingga termasuk reaksi eksoterm)
adalah - 112,5 kJ/mol (melepaskan kalor sehingga termasuk reaksi eksoterm)
Soal 3
Pada pembentukan 96 gram _{2}) (Ar Al = 27, N = 14, O = 16) dibebaskan kalor
(Ar Al = 27, N = 14, O = 16) dibebaskan kalor
sebesar 120 kJ.
b. Tuliskan persamaan termokimia pembentukan Al2(NO3)3!
Pembahasan :
Jumlah _{2}) yang dibentuk = 96 gram
yang dibentuk = 96 gram
mol _{2}) = gr/ Mr = 96/240 = 0,4 mol
= gr/ Mr = 96/240 = 0,4 mol
Artinya :
Untuk membentuk 0,4 mol _{2}) dibebaskan kalor sebesar 120 kJ
dibebaskan kalor sebesar 120 kJ
Untuk mencari kalor yang dibebaskan untuk 1 mol _{2}) adalah = 1/0,4 x 120 kJ = 300 kJ
adalah = 1/0,4 x 120 kJ = 300 kJ
b. Persamaan termokimia pembentukan _{2})
Persamaan termokimianya :
Soal 4
Pada pembentukan 10 gram 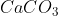 (Ar Ca = 40, C = 12, O = 16) diperlukan kalor sebesar 86 kJ. Tuliskan persamaan termokimia pembentukan
(Ar Ca = 40, C = 12, O = 16) diperlukan kalor sebesar 86 kJ. Tuliskan persamaan termokimia pembentukan 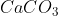 !
!
Pembahasan :
Jumlah 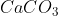 yang dibentuk = 10 gram
yang dibentuk = 10 gram
n 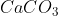 yang terbentuk = gr/Mr = 10/100 = 0,1 mol
yang terbentuk = gr/Mr = 10/100 = 0,1 mol
Artinya :
Untuk membentuk 10 gram 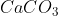 (0,1 mol
(0,1 mol 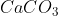 ) dibutuh kalor sebesar 86 kJ
) dibutuh kalor sebesar 86 kJ
Untuk mencari kalor yang dibutuhkan untuk membentuk 1 mol 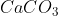 (standar) adalah = 1/0,1 x 86 kJ = 860 kJ
(standar) adalah = 1/0,1 x 86 kJ = 860 kJ
Persamaan termokimia
Soal 5
Diketahui 
 = 315 kJ/mol, berapakah kalor yang dibutuhkan untuk membentuk 159 gram
= 315 kJ/mol, berapakah kalor yang dibutuhkan untuk membentuk 159 gram  (Ar K = 39, P = 31, O = 16)!
(Ar K = 39, P = 31, O = 16)!
Pembahasan :
159 gram 
mol  = gr/Mr = 159/212 = 0,75 mol
= gr/Mr = 159/212 = 0,75 mol
Untuk membentuk 0,75 mol  dibutuhkan kalor sebesar
dibutuhkan kalor sebesar
Beberapa hal yang perlu diperhatikan berkaitan dengan entalpi pembentukan antara lain :
- Pada umumnya entalpi pemebntukan senyawa bertanda negatif. Hal ini menjunjukkan bahwa senyawa tersebut lebih stabil dibandingkan unsur unsurnya.
- Entalpi pemebntukan unsur dalam bentuk standarnya, misalnya entalpi pembentukan gas O2 sama dengan nol.
Setelah melihat beberapa contoh soal diatas, tentu kalian sudah paham bagaimana cara menentukan entalpi pemebntukan standar suatu senyawa serta menulis persamaan termokimianya. Untuk menguji pemahaman kalian silahkan jawab beberapa soal latihan berikut ini. Jika ada pertanyaan silahkan berkomentar di kolom postingan.
Soal latihan Menentukan Entalpi Pembentukan Standar
Soal 1
Dikeathui persamaan termokimia:
Soal 2
a. 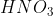 (g) = - 135kJ/mol
(g) = - 135kJ/mol
b. P(g) = 314,64 kJ/mol
Tulialah persamaan termokimia reaksi pembentukan zat zat tersebut!
Soal 3
Pada pembentukan 2 gram etanol [) ] dibebaskan kalor sebesar 12,07 kJ.
] dibebaskan kalor sebesar 12,07 kJ.
a. Tentukan entalpi pemebntukan etanol
b. Tuliskanlah persamaan termokimia pemebentukan etanol . (Ar H = 1, C = 12, O = 16)
Soal 4
Pada pemebntukan 10 gram ) dibebaskan 107 kJ kalor. Tuliskanlah persamaan termokimia reaksi pemebntukan
dibebaskan 107 kJ kalor. Tuliskanlah persamaan termokimia reaksi pemebntukan ) . (Ar O = 16, Mg = 24, S = 32)
. (Ar O = 16, Mg = 24, S = 32)
Soal 5