Kompetensi Dasar
- Menentukan reaksi berdasarkan percobaan, hukum Hess, data perubahan entalpi pembentukan standar, dan data energi ikatan.
Indikator
- Menghitung harga ∆H reaksi melalui percobaan.
- Menghitung harga ∆H reaksi dengan menggunakan: data entalpi pembentukkan standar, diagram siklus, energi ikatan.
Pilihlah Jawaban Yang Benar
Soal 1
A. - 92
B. - 46
C. + 46
D. + 92
E. + 138
Soal 2
Diketahui perubahan entalpi sebagai berikut :
Perubahan entalpi pada pembentukan gas metana sebesar . . . .kJ/mol
A. - 393,5
B. - 75,1
C. + 75,1
D. + 285,5
E. +393,5
Soal 3
Diekatahui reaksi :
A. + 450
B. + 225
C - 225
D. - 300
E. - 450
Soal 4
Diketahui persamaan rekasi kimia berikut ini.
A. (a + b)
B. (2a + b)
C. (2a - b)
D. (b - 2a)
E. (2b + a)
Soal 5
A. 63,0
B. 30,0
C. 25,2
D. 18,9
E. 12,6
Soal 6
Diberikan dua rekasi pembakaran berikut .
A. - 2.520
B. - 1.520
C. - 840
D. + 840
E. + 2.520
Soal 7
Air sebanyak 2 Liter dipanaskan dengan pembakaran elpiji dari suhu  menjadi
menjadi  . Elpiji dianggap mengandung
. Elpiji dianggap mengandung 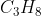 (Mr = 44) dan yang terbakar sebanyak 44 gram. Seluruh energi yang terbakar digunakan untuk menaikkan suhu air. Jika diketahu massa jenis air =
(Mr = 44) dan yang terbakar sebanyak 44 gram. Seluruh energi yang terbakar digunakan untuk menaikkan suhu air. Jika diketahu massa jenis air = , dan kalor jenis air =
, dan kalor jenis air =  , besarnya perubahan entalpi rekasi pembakaran elpiji . . . . .kJ/mol
, besarnya perubahan entalpi rekasi pembakaran elpiji . . . . .kJ/mol
A. - 403,2
B. - 4,18
C. 4,18
D. 403,2
E. 420
Soal 8
Diketahui data persamaan termokimia berikut!
A. - 856
B. - 984
C. - 1.161
D. - 1,904
E. - 1.966
Soal 9
A. - 284,3
B. - 110,9
C. +110,9
D. + 284,3
E. + 679,5
Soal 10
Kalor pembakaran propana sebesar - 2.220 kj/mol
Energi panas yang dihailkan ketika 11 gram karbondioksida dihasilkan dari pembakaran sempurna propana adalah . . . . .kJ
A. 1/4 x 1/3 x (-2.220)
B. 4 x 3 x (-2.220)
C. 1/3 x (-2.220)
D. 1/4 x (-2.220)
E. 3/4 x (-2.220)
Soal 11
Perhatikan diagram berikut!
Harga yaitu . . . kJ
A. 180
B. 147
C. 123
D. - 123
E. - 147
Soal 12
Perhatikan persamaan rekasi kimia berikut!
Berdasarkan reaksi diatas, grafik yang menunjukkan proses reksi tersebut adalah . . . . .
Soal 13
Diketahui energi ikatan rata - rata :
C = C = 607 kJ/mol
C - C = 343 kJ/mol
C - H = 410 kJ/mol
O - H = 460 kJ/mol
C - O = 351 kJ/mol
Perubahan entalpi pada reaksi :
Sebesar . . . . kJ/mol
A. - 111
B. - 74
C. - 37
D. +37
E. + 111
Soal 14
A. - 140,6
B. - 95,4
C. + 95,4
D. + 140,6
E. + 361
Soal 15
Persamaan rekasi untuk pembakaran etanol dengan oksigen berlebih ditunjukkan dibawah ini.
Diagram tingkat energi yang menunjukkan rekasi di atas adalah . . . . .





