Kita sering melihat di buku - buku bentuk suatu senyawa digambarkan dalam bdan datar.
Apakah benar demikian bentuk atom atom itu berikatan membentuk molekul ???
Pernahkan kalian bayangkan bagaimana bentuk suatu molekul senyawa dalam ruang tiga dimensi ???
Nah itulah yang akan kita bahas pada kesempatan kali ini . . . . .
Bentuk molekul = geometri molekul
Berguna untuk menggambarkan susunan atom atom dalam suatu molekul berdasarkan letak pasangan elektron dalam molekul itu.
Pasangan elektron ini bisa jadi yang dipakai oleh atom dalam berikatan atau pasangan elektron bebas.
Ada dua teori yang digunakan untuk menggambarkan atau meramalkan bentuk molekul suatu senyawa. Pada postingan ini kita akan bahas salah satunya adalah dengan menggunakan Teori Domain Elektron dajn VSEPR.
Teori Domain Elektron = Teori VSEPR (Valence Shell Elektron Pair Repulsion)
Domain elektron
Adalah area atau daerah dalam atom yang ditempati oleh elektron yang ada pada atom pusat.
Domain elektron = Pasangan Elektron = terdiri dari pasangan elektron ikatan (PEI) baik ikatan tunngal, rangkap dua atau rangkap tiga dan pasangan elektron bebas (PEB).
PEB dan PEI akan saling tolak menolak karena sama sama bermuatan negatif sampai jarak tertentu sehingga tolakan keduanya seminimal mungkin.
Tolakan PEB dan PEI yang terikat pada atom pusat akan mempengaruhi bentuk molekul suatu senyawa. Oleh karena itu teori VSEPR maupun teori domain elektron membahas dan meramalkan bentuk molekul suatu senyawa berdasarkan tolakan antara domain (PEB dan PEI) di atom pusat.
Ada 5 macam bentuk dasar molekul berdasarkan teori domain elektron :
Dengan Cara Menggambar Struktur Lewis
Contoh :
Bentuk molekul
Perhatikan struktur lewis diatas. Terdapat dua domain elektron pada molekul
diatas. Terdapat dua domain elektron pada molekul  (2 PEI). Keduanya akan mencapai tolakan minimum ketika ikatan berada pada posisi
(2 PEI). Keduanya akan mencapai tolakan minimum ketika ikatan berada pada posisi 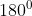 . Sehingga bentuk geometri molekul
. Sehingga bentuk geometri molekul  adalah linier.
adalah linier.
Bentuk molekul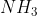
Perhatikan struktur lewis molekul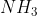 diatas. Dua jenis tolakan dalam molekul yaitu tolakan antara PEB dengan PEI dan sesama PEI. Berdasarkan percobaan, urutan gaya tolakan antara domain elektron dari yang terbesar adalah PEB - PEB, PEB - PEI dan PEI - PEI.
diatas. Dua jenis tolakan dalam molekul yaitu tolakan antara PEB dengan PEI dan sesama PEI. Berdasarkan percobaan, urutan gaya tolakan antara domain elektron dari yang terbesar adalah PEB - PEB, PEB - PEI dan PEI - PEI.
Pada molekul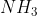 , karena tolakan PEB - PEI lebih besar dibandingkan dengan PEI - PEI, ia akan mendorong ikatan lain sedemikian rupa sehingga tolakannya minimum. Akibatnya sudut yang dibentuk akan lebih kecil dibandingkan dalam bentuk molekul tetrahedral.
, karena tolakan PEB - PEI lebih besar dibandingkan dengan PEI - PEI, ia akan mendorong ikatan lain sedemikian rupa sehingga tolakannya minimum. Akibatnya sudut yang dibentuk akan lebih kecil dibandingkan dalam bentuk molekul tetrahedral.
Bentuk molekul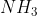 adalah trigonal bipiramida.
adalah trigonal bipiramida.
Cara ini memang agak sedikit sulit karena kita harus memperkirakan bentuk molekul berdasarkan tolakan domain elektron.
Cara lebih mudah adalah cara kedua.
Menentukan tipe molekul berdasarkan teori VSEPR
Tipe Molekul =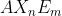
Keterangan :
A = Atom pusat
X = Pasangan Elektron Ikatan (PEI)
n = Jumlah PEI
E = Pasangan Elektron Bebas (PEB)
m = Jumlah PEB
Jumlah PEI atau X dihitung berdasarkan domain elektron ikatan yaitu baik ikatan tunggal, rangkap dua atau rangkap tiga dihitung sebagai satu domain. Atau agar lebih mudah lihat saja jumlah atom yang terikat pada atom pusat.
Contoh :
Molekul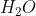 , jumlah PEI adalah 2, karena ada dua atom H yang berikatan dengan atom O sebagai atom pusat.
, jumlah PEI adalah 2, karena ada dua atom H yang berikatan dengan atom O sebagai atom pusat.
Sedangkan PEB atau jumlah E dapat dicari dengan menggunakan rumus =
Elektron ikatan adalah jumlah elektron atom pusat yang digunakan untuk berikatan dengan atom lain.
Yang perlu diperhatikan jika atom yang terikat pada atom pusat memiliki :
ev = 1 dan 7 ikatan tunggal jumlah elektron ikatan = 1
ev = 6 ikatan rangkap dua jumlah elektron ikatan = 2
ev = 5 ikatan rangkap tiga jumlah elektron ikatan = 3
Hubungan PEB , PEI dalam atom pusat dan bentuk molekul senyawa ditunjukkan oleh gambar berikut ini :
Contoh :
Tentukanlah bentuk molekul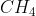 dengan nomor atom C= 6, H = 1?
dengan nomor atom C= 6, H = 1?
Jawab :
Untuk menjawabnya, saya memberikan langkah langkah berikut agar lebih mudah utuk dipahami. Istilah yang saya gunakan mungkin ada perbedaan dengan yang ada di buku, tapi konsepnya sama. Tujuannya adalah agar lebih simple dan mudah dipahami saja.
Langkah 1
Menentukan jumlah elektron valensi masing masing atom
C (nomor atom 6 ) = 2 4 Jumlah elektron valensi = 4
Jumlah elektron valensi = 4
H (nomor atom 1) = 1 Jumlah elektron valensi = 1
Jumlah elektron valensi = 1
Langkah 2
Menentukan atom pusat = Atom yang jumlahnya paling sedikit.
Pada molekul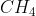 atom yang jumlahnya paling sedikit adalah C sebagai atom pusat.
atom yang jumlahnya paling sedikit adalah C sebagai atom pusat.
Langkah 3
Menentukan jumlah X atau PEI
Ada 4 buah atom H yang terikat pada atom pusat C, sehingga jumlah PEI atau X nya adalah 4.
Langkah 4
Menentukan jumlah E atau PEB
Jumlah elektron valensi atom pusat = 4
Jumlah elektron ikatan = 4 ( karena ev atom H adalah 1, jadi pasti akan membentuk ikatan tunggal, satu ikatan tunggal membutuhkan 1 buah elektron dari atom pusat C, jika ada 4 buah ikatan tunggal, maka jumlah elektron ikatannya adalah 4)
E = (ev atom pusat - jumlah elektron ikatan) 2 = = 0
= 0
Sehingga Tipe Molekul dari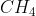 adalah
adalah 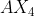
Bentuk molekul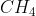 (Lihat pada tabel diatas, Nanti silahkan kalian hafal ya . . . .) = Tetrahedral
(Lihat pada tabel diatas, Nanti silahkan kalian hafal ya . . . .) = Tetrahedral
Apakah Sudah Mengerti???
Jika belum kita coba beberapa soal lagi ya.....
Soal 2
Tentukanlah bentuk molekul dari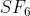 (nomor atom S = 16, dan F = 9)
(nomor atom S = 16, dan F = 9)
Jawab :
S (nomor atom 16) = 2 8 6 jumlah elektron valensi = 6
jumlah elektron valensi = 6
F (nomor atom 9) = 2 7 jumlah elektron valenis = 7
jumlah elektron valenis = 7
Atom pusat = S (jumlah paling sedikit)
Jumlah PEI atau X = 6 (ada 6 atom F yang terikat pada atom pusat S)
Jumlah E atau PEB
= (ev atom pusat - Jumlah elektron ikatan) / 2 =
Tipe Molekul =
Bentuk Molekul = Oktahedral
Soal 3
Tentukanlah bentuk molekul dari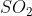 ( nomor atom S = 16, O =16)
( nomor atom S = 16, O =16)
Jawab :
S (nomor atom 16) = 2 8 6 jumlah elektron valensi = 6
jumlah elektron valensi = 6
O (nomor atom 8) = 2 6 jumlah elektron valensi = 6
jumlah elektron valensi = 6
Atom pusat = S
Jumlah PEI atau X = 2 (ada 2 buah atom O yang terikat pada atom pusat S)
Jumlah elektron ikatan = 4 (karena atom O dengan elektron valensi 6 akan membentuk ikatan rangkap dua dengan atom pusat S, sehingga jumlah elektron atom S yang digunakan untuk berikatan adalah 4 buah(
Jumlah PEB atau E = (ev atom pusat - jumlah elektron ikatan) / 2 =
Tipe molekul =
Bentuk molekul = Sudut atau bentuk V
Apakah benar demikian bentuk atom atom itu berikatan membentuk molekul ???
Pernahkan kalian bayangkan bagaimana bentuk suatu molekul senyawa dalam ruang tiga dimensi ???
Nah itulah yang akan kita bahas pada kesempatan kali ini . . . . .
Bentuk molekul = geometri molekul
Berguna untuk menggambarkan susunan atom atom dalam suatu molekul berdasarkan letak pasangan elektron dalam molekul itu.
Pasangan elektron ini bisa jadi yang dipakai oleh atom dalam berikatan atau pasangan elektron bebas.
Ada dua teori yang digunakan untuk menggambarkan atau meramalkan bentuk molekul suatu senyawa. Pada postingan ini kita akan bahas salah satunya adalah dengan menggunakan Teori Domain Elektron dajn VSEPR.
Teori Domain Elektron = Teori VSEPR (Valence Shell Elektron Pair Repulsion)
Domain elektron
Adalah area atau daerah dalam atom yang ditempati oleh elektron yang ada pada atom pusat.
Domain elektron = Pasangan Elektron = terdiri dari pasangan elektron ikatan (PEI) baik ikatan tunngal, rangkap dua atau rangkap tiga dan pasangan elektron bebas (PEB).
PEB dan PEI akan saling tolak menolak karena sama sama bermuatan negatif sampai jarak tertentu sehingga tolakan keduanya seminimal mungkin.
Tolakan PEB dan PEI yang terikat pada atom pusat akan mempengaruhi bentuk molekul suatu senyawa. Oleh karena itu teori VSEPR maupun teori domain elektron membahas dan meramalkan bentuk molekul suatu senyawa berdasarkan tolakan antara domain (PEB dan PEI) di atom pusat.
Ada 5 macam bentuk dasar molekul berdasarkan teori domain elektron :
- Linier
dengan sudut ikatan =
- Segitiga Datar
dengan sudut ikatan =
- Tetrahedral
dengan sudut ikatan =
- Trigonal bipiramida
dengan sudut ikatan ekuatorial =
dan sudut ikatan aksial =
- Oktahedral
dengan sudut ikatan =
Bagaimana menentukan bentuk suatu molekul menggunakan teori domain elektron dan VSEPR???
Dengan Cara Menggambar Struktur Lewis
Contoh :
Bentuk molekul
Perhatikan struktur lewis
Bentuk molekul
Perhatikan struktur lewis molekul
Pada molekul
Bentuk molekul
Cara ini memang agak sedikit sulit karena kita harus memperkirakan bentuk molekul berdasarkan tolakan domain elektron.
Cara lebih mudah adalah cara kedua.
Menentukan tipe molekul berdasarkan teori VSEPR
Tipe Molekul =
Keterangan :
A = Atom pusat
X = Pasangan Elektron Ikatan (PEI)
n = Jumlah PEI
E = Pasangan Elektron Bebas (PEB)
m = Jumlah PEB
Jumlah PEI atau X dihitung berdasarkan domain elektron ikatan yaitu baik ikatan tunggal, rangkap dua atau rangkap tiga dihitung sebagai satu domain. Atau agar lebih mudah lihat saja jumlah atom yang terikat pada atom pusat.
Contoh :
Molekul
Sedangkan PEB atau jumlah E dapat dicari dengan menggunakan rumus =
Elektron ikatan adalah jumlah elektron atom pusat yang digunakan untuk berikatan dengan atom lain.
Yang perlu diperhatikan jika atom yang terikat pada atom pusat memiliki :
ev = 1 dan 7 ikatan tunggal jumlah elektron ikatan = 1
ev = 6 ikatan rangkap dua jumlah elektron ikatan = 2
ev = 5 ikatan rangkap tiga jumlah elektron ikatan = 3
Hubungan PEB , PEI dalam atom pusat dan bentuk molekul senyawa ditunjukkan oleh gambar berikut ini :
Contoh :
Tentukanlah bentuk molekul
Jawab :
Untuk menjawabnya, saya memberikan langkah langkah berikut agar lebih mudah utuk dipahami. Istilah yang saya gunakan mungkin ada perbedaan dengan yang ada di buku, tapi konsepnya sama. Tujuannya adalah agar lebih simple dan mudah dipahami saja.
Langkah 1
Menentukan jumlah elektron valensi masing masing atom
C (nomor atom 6 ) = 2 4
H (nomor atom 1) = 1
Langkah 2
Menentukan atom pusat = Atom yang jumlahnya paling sedikit.
Pada molekul
Langkah 3
Menentukan jumlah X atau PEI
Ada 4 buah atom H yang terikat pada atom pusat C, sehingga jumlah PEI atau X nya adalah 4.
Langkah 4
Menentukan jumlah E atau PEB
Jumlah elektron valensi atom pusat = 4
Jumlah elektron ikatan = 4 ( karena ev atom H adalah 1, jadi pasti akan membentuk ikatan tunggal, satu ikatan tunggal membutuhkan 1 buah elektron dari atom pusat C, jika ada 4 buah ikatan tunggal, maka jumlah elektron ikatannya adalah 4)
E = (ev atom pusat - jumlah elektron ikatan) 2 =
Sehingga Tipe Molekul dari
Bentuk molekul
Apakah Sudah Mengerti???
Jika belum kita coba beberapa soal lagi ya.....
Soal 2
Tentukanlah bentuk molekul dari
Jawab :
S (nomor atom 16) = 2 8 6
F (nomor atom 9) = 2 7
Atom pusat = S (jumlah paling sedikit)
Jumlah PEI atau X = 6 (ada 6 atom F yang terikat pada atom pusat S)
Jumlah E atau PEB
= (ev atom pusat - Jumlah elektron ikatan) / 2 =
Tipe Molekul =
Bentuk Molekul = Oktahedral
Soal 3
Tentukanlah bentuk molekul dari
Jawab :
S (nomor atom 16) = 2 8 6
O (nomor atom 8) = 2 6
Atom pusat = S
Jumlah PEI atau X = 2 (ada 2 buah atom O yang terikat pada atom pusat S)
Jumlah elektron ikatan = 4 (karena atom O dengan elektron valensi 6 akan membentuk ikatan rangkap dua dengan atom pusat S, sehingga jumlah elektron atom S yang digunakan untuk berikatan adalah 4 buah(
Jumlah PEB atau E = (ev atom pusat - jumlah elektron ikatan) / 2 =
Tipe molekul =
Bentuk molekul = Sudut atau bentuk V



